1.守恒律
①质量守恒:前后反应各元素原子数不变
②电子得失守恒:还原剂失电子总数=氧化剂原子得电子总数
③化合价守恒:还原剂元素化合价升高总数=氧化剂元素化合价降低总数
2.强弱规律
①越容易失电子的物质,失电子后就越难得电子;越容易得电子的物质,得电子后越难失电子
②氧化剂最先和还原性最强的还原剂反应;同理,还原剂首先与氧化性最强氧化剂反应
3.反应先后规律:多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化
4.价态规律
元素处于最高价,只有氧化性;
元素处于最低价,只有还原性;
元素处于中间价态既有氧化性,又有还原性,但主要表现一种性质
5.价态归中规律
同一元素不同价态发生氧化还原反应,价态规律遵循高价+低价→中间价态(不能交叉)
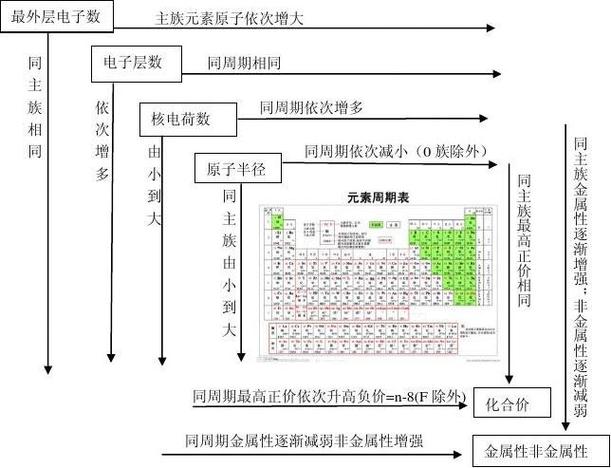
在元素周期表中,同一周期的金属元素还原性逐渐变弱;非金属元素的氧化性逐渐增强。
同一主族元素的金属元素还原性逐渐增强;非金属元素的氧化性逐渐减弱。